Dalam kimia, reaksi dehidrasi adalah perubahan yang melibatkan hilangnya air secara total dalam elemen atau molekul yang bereaksi.
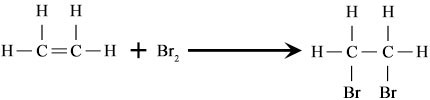
Reaksi hidrasi adalah kejadian yang sangat umum, kebalikan dari reaksi dehidrasi lengkap. Agen dehidrasi yang umum digunakan dalam sintesis kimia termasuk alumina, asam sulfat, dan urea.
Dalam kimia organik, radikal hidroksil terbentuk di lingkungan asam. Fungsi utama ion hidroksil dalam hal ini adalah membantu netralisasi senyawa lain. Namun, dalam sintesis kimia, radikal hidroksil juga dapat diaktifkan. Ketika ini terjadi, ion hidroksil ditemukan dengan adanya zat lain seperti alkohol, amina, dan keton. Proses ini dikenal sebagai reaksi dehidrasi.
Selain reaksi dengan ion hidroksil, reaksi dengan alkohol dapat menyebabkan hidrolisis ikatan kimia lainnya. Laju terjadinya hal ini akan bergantung pada konsentrasi dan durasi pemaparan terhadap alkohol dalam larutan tertentu. Alkohol juga dapat bereaksi dengan ion hidroksil untuk menghasilkan keton. Laju reaksi ini sangat cepat dan dapat terjadi dalam beberapa menit setelah alkohol dimasukkan ke dalam larutan.
Dalam kimia organik, dehidrasi merupakan langkah penting dalam beberapa reaksi kimia penting. Ketika ion hidroksil diubah menjadi keton, mereka membentuk radikal keton yang bermuatan positif.
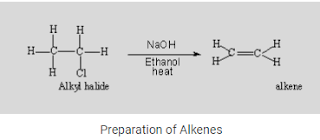
Keadaan bermuatan negatif ini menghasilkan elektron yang dipindahkan dari atom. Elektron ini kemudian bertanggung jawab atas pelepasan energi dan penghancuran ikatan.
Secara umum, efek dehidrasi terlihat dengan adanya alkohol dalam jumlah besar. Semakin tinggi konsentrasi alkohol, semakin besar laju reaksinya. Oleh karena itu, tidak mengherankan jika kebanyakan sintesis alkohol dimulai dengan adanya alkohol dalam konsentrasi tinggi. Sejumlah turunan radikal hidroksil dan keton yang berbeda ada yang dapat diaktifkan oleh alkohol.
Radikal hidroksil dapat diproduksi ketika senyawa organik, seperti belerang, amonia, urea, atau amonia, bereaksi dengan air untuk membentuk radikal hidroksil. Meskipun radikal hidroksil sangat reaktif, ia dianggap sebagai bentuk lemah dari radikal hidrogen (H). Ini berarti ia tidak dapat bereaksi dengan oksigen atau logam apa pun. senyawa yang mengandung elektron. Ini juga dianggap sebagai bentuk molekul hidrogen yang paling tidak reaktif.
Salah satu kegunaan utama radikal hidroksil adalah dalam produksi keton. Keton digunakan untuk pembuatan berbagai jenis obat.
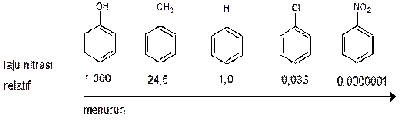
Keton digunakan untuk menggantikan amonia sebagai komponen utama perawatan kemoterapi. Sejumlah senyawa organik lain yang mengandung keton digunakan untuk pembuatan berbagai macam senyawa kimia.
Selain radikal hidroksil, keton juga dapat dibentuk sebagai produk sampingan dalam reaksi dehidrasi. Kadang-kadang ditambahkan untuk mensintesis garam keton yang digunakan untuk menghasilkan berbagai jenis bahan kimia. Stabilitas produk dan kemampuannya untuk berinteraksi dengan bahan kimia lain sangat bergantung pada kondisi pembuatannya. Inilah sebabnya mengapa banyak turunan ion hidroksil tidak stabil bila dibuat dengan air saja. Selain itu, kestabilan senyawa ini juga dapat bervariasi tergantung pada variabel yang berbeda.
Turunan radikal hidrogen dan hidroksil juga penting dalam sintesis keton. Keton biasanya diproduksi dengan adanya sulfur, amonia, urea atau alkohol berlebih dan digunakan sebagai katalis untuk konversi senyawa organik menjadi keton. Keton kemudian digunakan untuk membuat berbagai jenis agen katalitik, seperti hidrogen peroksida (HOCl) dan asam sulfat (SO4). Keton juga dapat digunakan dalam sintesis berbagai bahan kimia lainnya, termasuk nitrogen dioksida (N2O).
Ada beberapa alasan mengapa keton digunakan dalam reaksi dehidrasi. Secara umum, tidak diketahui mengapa radikal hidroksil diproduksi, tetapi diyakini berperan dalam pembentukan radikal lainnya.
Salah satu peran yang diketahui dari turunan radikal hidroksil adalah mengaktifkan radikal hidroksil dalam radikal hidroksil. Hal ini pada gilirannya menyebabkan pembentukan radikal hidroksil lain yang dapat diubah menjadi senyawa lain dalam radikal hidroksil.